테마주뉴스
테마주뉴스
시노펙스, 혈액여과기 유럽 CE MDR 인증 위한 임상 마무리
파이낸셜뉴스 2025.08.07 09:05 댓글0
글로벌 시장 공략 위한 중요한 포석
IRB 승인 환자임상 3개 투석센터 진행
국내 혈액투석 전문 병원 40곳 사용
연말 100개 병원으로 확대
[파이낸셜뉴스] 시노펙스가 유럽 CE MDR 인증 조건인 임상시험윤리위원회(IRB) 승인 환자 임상시험을 성공적으로 마쳤다고 7일 밝혔다.
이번 임상시험은 최근 강화된 멀티롤 조건을 적용, 부산 범일연세내과와 서울 연세푸른내과, 연세유내과 등 3개 혈액투석 전문병원에서 유럽 CE MDR 인증 규정에 맞춰 진행했다.
시노펙스는 지난해 10월 임상 전문 'CRO(Contract Research Organization)' 업체와 계약을 체결, 해외 인증 요건에 맞춘 병원 확보 및 각 병원 IRB 승인을 마치고 지난 3월부터 총 25명 환자를 대상으로 4개월간 임상을 진행했다.
시노펙스는 이번 임상 결과를 바탕으로 유럽 CE MDR 인증을 위한 기술문서 작성 등 후속 조치를 진행해 연내 인증 신청 접수를 마무리할 계획이다.
이진태 시노펙스 인공신장사업본부 본부장은 "이번 임상은 새롭게 강화된 CE MDR 승인 규정에 맞춰 서울과 부산 등 혈액투석전문병원 3곳에서 25명 환자를 대상으로 진행했다"며 "기대 이상 결과가 나오면서 유럽 CE MDR 인증 획득이 가능할 것"이라고 말했다.
특히 이번 CE MDR 인증을 위한 임상과 별도로 서울대병원 등 5개 상급병원에서 시노펙스 혈액여과기와 독일 기업 제품을 비교 임상한 결과 일반 항목인 요소제거율, 투석적절도 등에서 비열등성이 나타났다. 환자 생존율과 심혈관 질환, 감염, 염증 등 혈액투석에 따른 합병증 예방 중요 항목인 중분자 제거율에서는 우월한 성능을 보였다.
임상 결과는 지난 6월 SCI급 국제학술지 'Kidney Research and Clinical Practice'에 공식 논문으로 게재, 시노펙스 혈액여과기 안전성과 효능을 학술적·임상적으로 입증 받았다.
한편 혈액 투석 핵심 제품인 혈액여과기는 지난 60년간 전량 수입에 의존해왔다. 시노펙스는 국산화 혈액여과기를 출시해 국내 시장에 공급을 진행 중이다. 현재 시노펙스는 지역별 주요 거점 병원을 대상으로 40여곳에 제품을 공급했다. 연말까지 100개 병원 공급을 목표로 한다.
butter@fnnews.com 강경래 기자
Copyrightⓒ 파이낸셜뉴스. 무단전재 및 재배포 금지.
IRB 승인 환자임상 3개 투석센터 진행
국내 혈액투석 전문 병원 40곳 사용
연말 100개 병원으로 확대
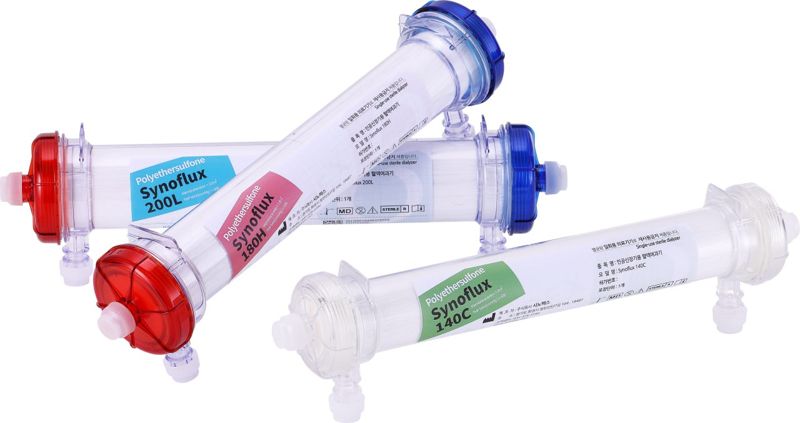 |
| 시노펙스 혈액여과기. 시노펙스 제공 |
[파이낸셜뉴스] 시노펙스가 유럽 CE MDR 인증 조건인 임상시험윤리위원회(IRB) 승인 환자 임상시험을 성공적으로 마쳤다고 7일 밝혔다.
이번 임상시험은 최근 강화된 멀티롤 조건을 적용, 부산 범일연세내과와 서울 연세푸른내과, 연세유내과 등 3개 혈액투석 전문병원에서 유럽 CE MDR 인증 규정에 맞춰 진행했다.
시노펙스는 지난해 10월 임상 전문 'CRO(Contract Research Organization)' 업체와 계약을 체결, 해외 인증 요건에 맞춘 병원 확보 및 각 병원 IRB 승인을 마치고 지난 3월부터 총 25명 환자를 대상으로 4개월간 임상을 진행했다.
시노펙스는 이번 임상 결과를 바탕으로 유럽 CE MDR 인증을 위한 기술문서 작성 등 후속 조치를 진행해 연내 인증 신청 접수를 마무리할 계획이다.
이진태 시노펙스 인공신장사업본부 본부장은 "이번 임상은 새롭게 강화된 CE MDR 승인 규정에 맞춰 서울과 부산 등 혈액투석전문병원 3곳에서 25명 환자를 대상으로 진행했다"며 "기대 이상 결과가 나오면서 유럽 CE MDR 인증 획득이 가능할 것"이라고 말했다.
특히 이번 CE MDR 인증을 위한 임상과 별도로 서울대병원 등 5개 상급병원에서 시노펙스 혈액여과기와 독일 기업 제품을 비교 임상한 결과 일반 항목인 요소제거율, 투석적절도 등에서 비열등성이 나타났다. 환자 생존율과 심혈관 질환, 감염, 염증 등 혈액투석에 따른 합병증 예방 중요 항목인 중분자 제거율에서는 우월한 성능을 보였다.
임상 결과는 지난 6월 SCI급 국제학술지 'Kidney Research and Clinical Practice'에 공식 논문으로 게재, 시노펙스 혈액여과기 안전성과 효능을 학술적·임상적으로 입증 받았다.
한편 혈액 투석 핵심 제품인 혈액여과기는 지난 60년간 전량 수입에 의존해왔다. 시노펙스는 국산화 혈액여과기를 출시해 국내 시장에 공급을 진행 중이다. 현재 시노펙스는 지역별 주요 거점 병원을 대상으로 40여곳에 제품을 공급했다. 연말까지 100개 병원 공급을 목표로 한다.
butter@fnnews.com 강경래 기자
Copyrightⓒ 파이낸셜뉴스. 무단전재 및 재배포 금지.
- 1'엔캐리 트레이드 청산 공포' 기우였나, 뉴욕증시 AI 강세에 이틀째 상승
- 2엔비디아, H200 대중 수출 허용 기대감에 급등
- 3뉴욕증시, 엔비디아 급등에 이틀 연속 상승…테슬라는 숨 고르기
- 4[속보]뉴욕증시, AI 강세에 이틀 연속 상승…엔비디아, 3.9% 급등
- 5주유소 기름값 2주째 하락…다음 주도 내린다
- 6'불꽃야구' 영상 싹 다 지워질 위기… 법원은 "부정경쟁 행위" 라며 JTBC 손 들어줬다
- 7[속보] 윤석열 전 대통령, 김건희 특검 첫 피의자 조사 출석
- 8日 금리인상에도 '엔저'…유로 대비 엔화 가치 역대 최저
- 9국민의힘 "통일교 특검은 국민의 명령… 민주당 즉각 수용해야"
- 10문화체육관광부, 故 윤석화 배우 문화훈장 추서 추진
- [AD] 23일 추천주