셀트리온
FDA 자문위 심사에서 거론된 ADCC..코멘트1

FDA 관절염 자문위에서 토론되었던 이슈 중에서 "FcγRIIIa 결합 친화도"와 "ADCC"에 대해서 알아볼까 합니다.
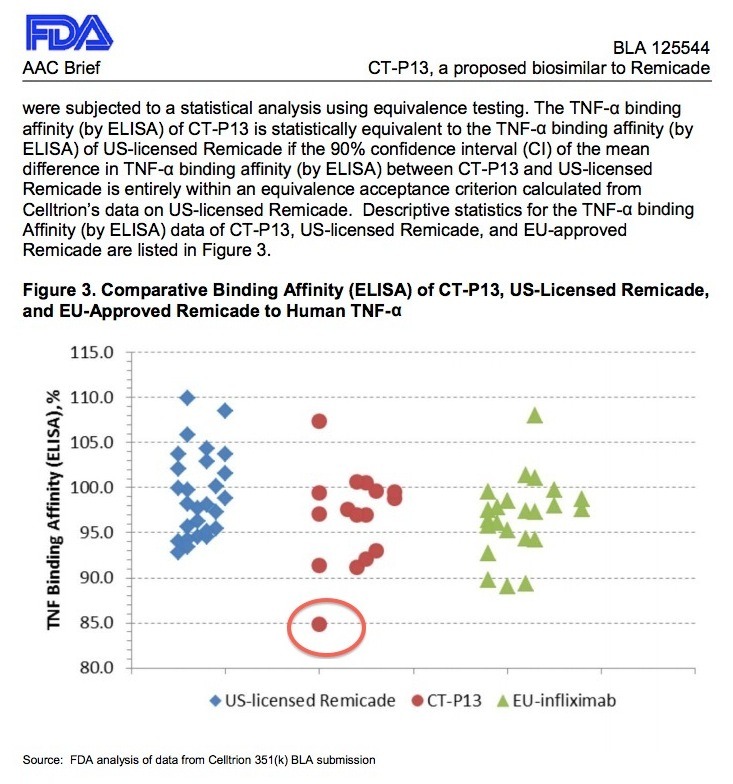
2월 9일 관절염 자문위에서 언급되었던 위 자료는 램시마가 레미케이드(미국산 및 유럽산 제품)의 범위를 벗어난 것처럼 보입니다. 그래서 램시마의 효능에 문제가 될 수 있을까요?
AAC(관절염 자문위원회) Brief에서도 이 이슈는 이미 언급되었답니다.
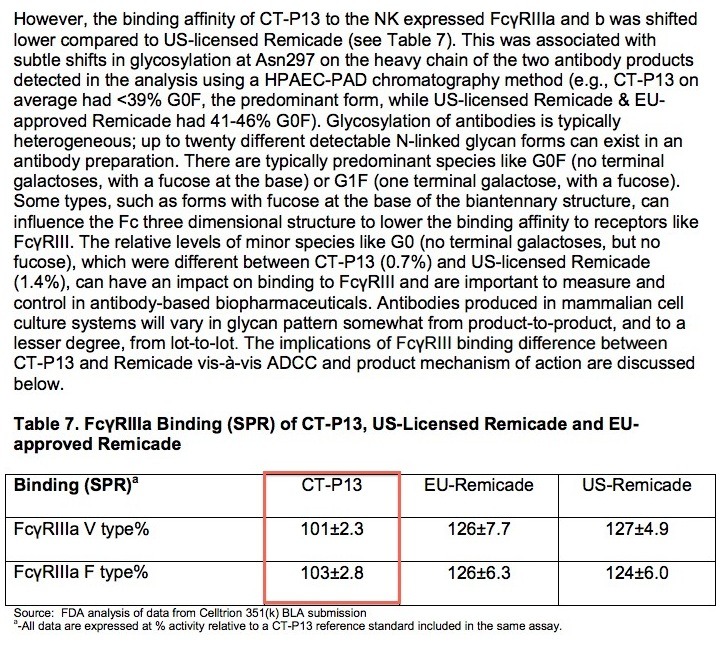
확실하게 램시마가 레미케이드 제품에 비해서 FcγRIIIa 결합 친화도가 더 낮습니다. 과연 이게 문제가 될 수 있을까요?
이것을 이해하기 위해서는 항체에 대해 기본적인 개념이 정립되어 있어야 합니다. CT-P13 램시마, 즉 인플릭시맙(성분명)은 키메릭 단일클론 항체로서, 종양 괴사 인자-알파(tumor necrosis factor-alpha) 억제제입니다. 인플릭시맙은 류마티스, 소화기, 피부 분야의 치료제로 승인받은 복잡한 글리코실화 단일클론 항체입니다.
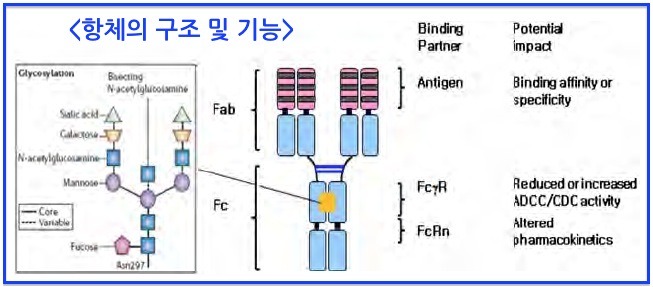
항체는 일반적으로 Y형태로 약 150 kDa의 4중체(tetramer)로 항원과 특이적으로 결합하는 부위인 가변영역(variable region 또는 Fab)과 결합된 항원을 제거하는 역할을 하는 불변영역(constant region or Fc)으로 구분됩니다. 가변영역은 항원에 대한 특이성을 갖고 있으며 항체마다 서로 다르며, 불변영역은 동일한 기능을 하며 항체마다 동일하죠. 항체의 가변영역 Fab에는 6개의 CDR (heavy chain variable region에 3개, light chain variable region에 3개)이 있으며 이들은 각각의 loop를 구성하고 있으며, 이들 6개의 loop들이 항원과의 특이적인 결합을 합니다. 항체의 Fc 부위에는 FcgR을 통해서 면역세포와 결합할 수 있기 때문에 항체의 Fc는 면역세포의 타겟이 될 수 있고, 따라서 항체가 결합한 세포를 죽일수 있게 됩니다.
항체는 면역글로불린 A, D, E, G, M의 5가지 아이소타입이 존재하며 이 중 주로 항체 의약품으로 사용되는 것은 IgG 타입입니다. IgG는 IgG1에서부터 IgG2, IgG3, IgG4까지 존재하며 이들의 구조적 특징은 주로 경첩이라고 알려져 있는 부위의 아미노산 수와 서열의 차이로 결정됩니다. 이 경첩 부위는 CH1과 CH2 부위 사이에 존재하며 이 부분이 길어지게 되면 유연성이 좋아져 항원과의 결합에 특이성을 결정하는 데에 중요한 요인이 될 수 있습니다. 또한, 이들 5가지 iso 타입들은 CH2와 CH3를 구성하는 아미노산 서열에도 차이가 있으며, 항체의 기본적인 특징인 항원과의 결합을 통한 중화 효과라는 기능 이외에도 항체가 가지는 다른 주요 기능인 항체 의존성 세포 독성 (ADCC)과 도움체 의존 세포 독성(CDC)을 결정할 수 있습니다. 즉, 다른 면역글로불린과는 다르게 IgG1의 경우에는 CH2와 CH3 부위에 존재하는 아미노산에 면역세포인 T림프구나 NKT셀이 결합 할 수 있습니다. 항체와 결합된 면역 세포들은 항체에 의해 활성화되어 항체가 결합하고 있는 세포들을 용해하게 되는데 이를 ADCC라고 하며, 보체가 결합하여 세포 용해를 일으키는 것을 CDC라고 합니다. ADCC와 CDC의 경우 항체의 중화 효과에 비해 보조적이라고 생각될 수도 있지만 매우 중요한 역할로서 항체 의약품 중에서, 특히 항암제로 제조되는 항체의 경우 항암 효능을 배가시켜 주는데 중요한 역할을 한다고 알려져 있습니다.
항체는 당이 결합되어 있는 당단백질로서 당화는 주로 Asn 잔기에 결합하는 N-당화와 Ser/Thr 잔기에 결합하는 O-당화가 있습니다. 항체에 결합돼 있는 당사슬은 숙주세포의 종류, 재조합체의 조작 방법, 그리고 배양 조건 등에 따라 그 구조나 형태가 달라질 수 있는데, 이와 같은 특성 때문에 현재 개발되고 있는 모든 바이오시밀러의 경우 오리지널 의약품이 제조된 세포와 생산공정을 거의 유사하게 적용하여 바이오시밀러 제품을 제조 하고 있죠.
생체내에서의 당쇄(Glyco chain)당쇄가 기관형성, 노화, 감염, 염증, 생체방어, 암화, 암전이, 조직변성, 재생, 세포사(apotosis), 등의 다양한 생명현상에 관여하고 있는데, 예를 들어서, 에너지 저장, 에너지 전달, 단백질 기능의 조절, 세포간 접착, 신호전달, 그리고 악성 형질전환 같은 것입니다. 지금까지 축적된 당쇄과학 연구의 성과는 항인플루엔자 바이러스제, 항혈액응고제, 관절염치료제 등의 우수한 의약품의 개발로서 나타나고 있습니다.
램시마가 EMA의 승인을 받을 때, "특정한 Fc 수용체를 향한 램시마의 낮은 결합 친화력 그리고 가장 민감한 '항체-의존적인 세포 독성'(ADCC) 분석에서 더 낮은 체외 ADCC 활성으로 변환하는 탈푸코실화된 단일클론 항체의 양에서 작은 차이"라고 명시했습니다. 즉, 병리 생리학적 조건에 있는 환자에게 더욱 관련 있는 임상 실험 모델에서 램시마의 활성에 영향을 주지 않기 때문에, 이런 차이점은 임상적으로 의미있게 고려되지 않았던 겁니다. 2013년 6월 모든 레미케이드 적응증에 대해서 램시마가 승인 권고를 받을 때, EMA(특히 CHMP)는 서면과 컨퍼런스를 통해서 '증거의 완전무결(totality of the evidence)'을 지속적으로 주장했습니다.
여기서, 탈푸코실화(afucosylated = 푸코스 잔기가 결핍된) 항체 형성 기술에 대해 알아볼까요? 항체의 Fc영역에 결합하는 N-Glycosyl결합 복합형당쇄에서 Fucose를 제거하면 FcγRIIIa 수용체에 대한 친화도를 향상시키며 ADCC활성이 대폭 증가하는 사실이 밝혀졌습니다. 단일클론 항체의 올리고사카라이드 성분을 조작하여 단일클론 항체 의존성 세포의 세포독성(ADCC)을 증강시킴으로써, 낮은 ADCC 활성을 갖게 만드는 기술을 탈푸코실화된 항체 형성 기술이라고 합니다.
따라서 탈푸코실화된 항체는 푸코스 잔기가 결핍된 항체이며, 항체의 단수화물 부분이 푸코스 잔기를 함유하지 않거나 푸코스 잔기가 제거된 항체를 의미합니다. 즉, 탄수화물 사슬로부터 푸코스 잔기를 제거하기 위하여 항체의 화학적 변형에 의해(예를 들면 푸코시다제로 항체를 처리함) 생성될 수 있습니다.
인간 면역글로불린 IgG의 당화(Glycosylation)는 아스파라긴(asparagine 297, Asn297) 이 탄수화물에 연결된 CH2 도메인 내의 보존된 N 당화 장소의 Fc 지역에서 발생합니다. 이 장소에서 탄수화물 체인은 N-아세틸글루코사민 (acetylglucosamine), 마노스 (mannose), 갈락토스 (galactose), 시알산 (sialic acid)과 푸코스 (fucose) 잔기를 포함합니다. 푸고스 제거나 당엔지니어링은 FcγRIIIa 수용체에 대한 친화성을 100 배 이상 증가시켜 ADCC 매개에 의한 세포독성을 향상시켰죠.
ADCC 활성이란 표적세포에 결합한 항체가 NK세포나 macrophage등의 effector세포막의 Fc수용체와 결합함으로서 항체 의존적으로 유도되는 표적세포상해 활성입니다. 항체의약의 약효발현 메카니즘으로서 ADCC 활성이나 CDC 활성 혹은 Apoptosis를 직접 유도하는 effector 활성이 중요하다는 사실은 옛날부터 지적되었지만 임상적으로 어떤 메카니즘이 가장 중요한지는 알려져 있지 않았죠. 최근에 이들 메카니즘 중에서 특히 ADCC 활성이 중요하다고 알려졌답니다. 이렇게 하여 유방암, 대장암, 혈액암에서 수명연장 결과를 주게 된 겁니다. 그리고, 비호지킨 임파종양이나 유방암 환자의 Fc 수용체 다형성를 해석하여 rituximab와 trastuzumab 2가지 모두 주요한 항종양 메카니즘의 하나가 ADCC 활성이라는 사실이 명확해졌구요. 사람의 FcγRIIIa 수용체의 158번째 아미노산이 Valine인 것(FcγRIIIa-158Val)과 Phenylalanine인 것 (FcγRIIIa-158Phe)의 유전자형이 존재합니다. 치료용 항체인 rituximab에 높은 친화성을 갖는 Fc수용체 FcγRIIIa-158Val을 가지고 있는 비호지킨 임파종양 환자는 낮은 친화성을 갖는 Fc수용체 FcγRIIIa-158Phe를 가지고 있는 비호지킨 임파종양 환자에 비하여 훨씬 높은 임상치료효과를 줍니다. trastuzumab(허셉틴)에 의한 유방암 치료에서도 높은 효과가 보였습니다. 이러한 결과는 임상적으로 효과있는 항체의약을 개발하기 위해 ADCC 활성이 중요함을 시시하는 것이죠. 그렇지만 항암제가 아닌 염증 치료제인 램시마의 경우에는 정반대입니다. 오히려 ADCC 활성에 의해 부작용이 생길 수 있기 때문입니다.
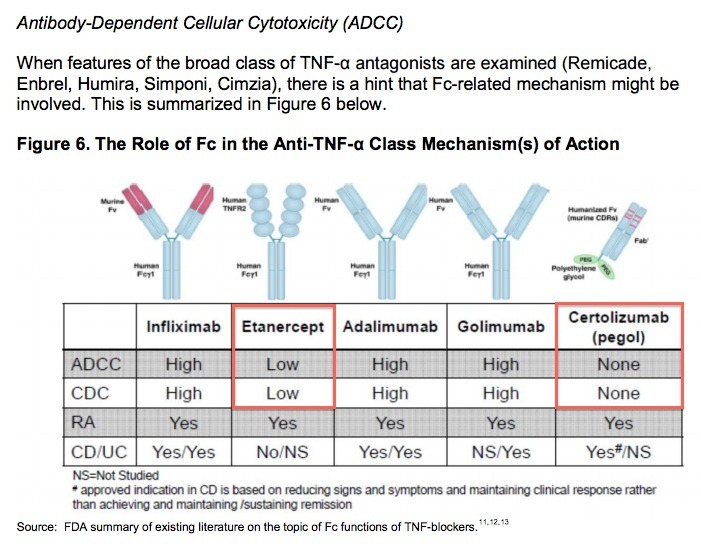
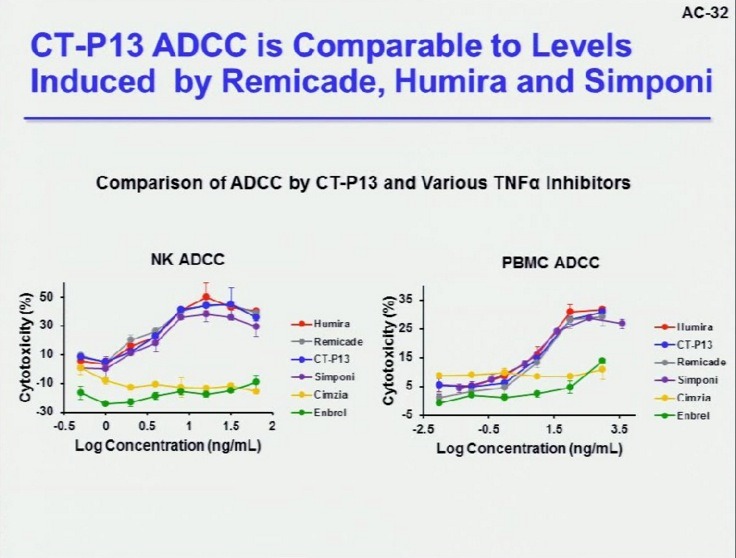
위 자료에 따르면 ADCC에 대해서 엔브렐과 심지아 제품이 훨씬 낮거나 없다고 합니다. 즉, TNF-알파 억제제의 경우에는 ADCC가 낮을수록 좋다는 의미입니다. 이를 확인한 데이터가 있습니다.
항체의 반감기는 항체의 Fc와 FcRn과의 결합에 의해서 조절이 됩니다. IgG 분자는 세포표면의 FcRn과 결합한뒤 endosome내의 낮은 pH (6.0~6.5)에서 안정화된후 다시 세포표면으로 나와서 분비되는 기작으로 긴 반감기를 갖게 되죠. 따라서 항체에 의해서 유도되는 ADCC 및 CDC는 질환에 따라서 항체의 효능을 증가시키거나 또는 항체의 부작용을 증가시킬수 있기 때문에 이들 부위의 변경은 치료 전략이나 임상 목적의 타겟이 될 수 있습니다.
[결론] 램시마가 레미케이드보다 항체의 효능이 개선된 것은 FcγRIIIa 결합 친화도에 의한 ADCC 차이가 어느 정도 영향을 주었을 듯. ^^
전문가방송




0/1000 byte